摘要:在過去十年中����,斑馬魚開始作為發(fā)育生物學的典范����,也得到了免疫學家和腫瘤學家的關(guān)注���。斑馬魚具有體積小、繁殖力強�����、基因組完整等特點����,是一個極具吸引力的模型體系�。事實上,魚在生命早期是透明的��,結(jié)合越來越多的魚免疫細胞報告���,可以在體內(nèi)追蹤完整機體的免疫反應�。由于斑馬魚從受精卵開始發(fā)育�,可以從生命的開始監(jiān)控免疫發(fā)育。斑馬魚是研究腸道炎癥和損傷基本過程的一種有趣的模式生物�����。本文將首先提供斑馬魚腸道發(fā)育、細菌定植和免疫的一些背景知識�����,顯示出與哺乳動物的相似性和差異性����。
關(guān)鍵詞:斑馬魚 小腸結(jié)腸炎 免疫 腸道 炎癥
簡介:事實上,魚在生命早期(2周)是透明的���,與免疫細胞報告魚的生長表相結(jié)合����,可以在體內(nèi)對完整機體的免疫反應進行跟蹤�����。由于斑馬魚從受精卵發(fā)育��,從生命開始就可以監(jiān)控免疫發(fā)育�����。在斑馬魚中,首先出現(xiàn)先天性免疫系統(tǒng)(巨噬細胞����、中性粒細胞和嗜酸性粒細胞),其次是適應性免疫����,從受精后的兩到三周開始發(fā)展。斑馬魚通常在受精后2天從絨毛膜孵化�����,盡管這取決于溫度�����。在較低溫度下生長魚類會延遲孵化�����。第3天斑馬魚開口���,整個胃腸管在受精后第6天開放。此時���,卵黃囊被消耗�����,幼蟲開始進食小原生動物�����,如草履蟲����。在幾個星期的過程中,腸道發(fā)展���,同時幾個細菌物種殖民胃腸道��。
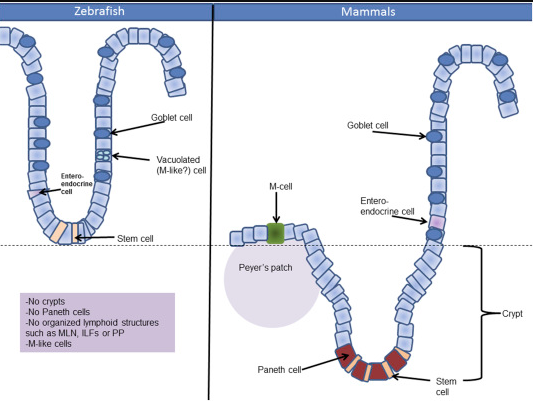
斑馬魚胃腸道:硬骨魚類是極其多樣化和豐富的魚類群���。當討論魚的胃腸道時,需要提到的一個重要特征是胃的存在�����。在硬骨魚類中,我們可以找到有和沒有胃的魚����。例如,尼羅羅非魚和大西洋鱈魚有胃�,而河豚、百里香���、鯉魚和斑馬魚缺乏胃�。胃腺首先出現(xiàn)在大約4億5000萬年前�����,似乎是大多數(shù)顎口(顎)脊椎動物的特征����。由于H+/K+ - ATPase(ATP4A和ATP4B)和編碼胃蛋白酶原的基因丟失,脊椎動物的胃腺喪失(脊椎動物腸的簡化)發(fā)生了數(shù)次�;斑馬魚不是胃����,而是有前腸,稱為腸球����,它比后部有更大的內(nèi)腔��,因此可以作為與胃相媲美的儲層���。然而,根據(jù)Nalband等人的研究�,這種腸球缺乏胃腺,因此沒有低pH值��。在穩(wěn)態(tài)條件下��,斑馬魚腸道的pH值不低于7.5���。斑馬魚的腸管形成始于體節(jié)中期至后期(18體節(jié))�,而在哺乳動物中����,腸道在早期體節(jié)開始形成(1~2體節(jié))。在18體節(jié)階段���,一個連續(xù)的內(nèi)層薄層變得可區(qū)分���,這將產(chǎn)生原始的腸內(nèi)胚層。盡管斑馬魚腸道形成較晚,腸管形成的時間順序是相同的�。與哺乳動物一樣,斑馬魚的喙腸首先形成���,其次是后腸和中腸�����。腸道斑馬魚上皮層缺乏腸隱窩���,然而,指狀突起稱為皺襞(絨毛)�,前部至后部的大小減小。發(fā)現(xiàn)不同分化的上皮細胞如吸收腸細胞(前腸和小腸)��、黏液產(chǎn)生杯狀細胞(整個腸)和腸內(nèi)分泌細胞(前腸)����。也沒有發(fā)現(xiàn)經(jīng)典的微體細胞(M)細胞,雖然第四上皮細胞類型被確定在腸的后段��,其中含有大量空泡����,其中可以存儲腔內(nèi)容物。Payle的缺失和卵泡相關(guān)上皮的缺乏提示斑馬魚沒有M細胞����,然而,上述M型空泡化細胞可能將管腔內(nèi)容傳遞給存在于上皮層之下的分散免疫細胞���。與哺乳動物相反��,斑馬魚沒有粘膜下層�����。哺乳動物的粘膜下層是一層疏松的結(jié)締組織����,包含血液和淋巴管和神經(jīng)���,位于粘膜下面(絨毛)�����,將粘膜與下方的平滑肌層連接起來����。在斑馬魚中,平滑肌層不那么復雜�,直接附著在粘膜上。斑馬魚的腸神經(jīng)細胞體存在于圓形和縱向平滑肌層之間����。像哺乳動物一樣,上皮細胞從褶皺的底部遷移到細胞凋亡的褶皺頂端�����。BrdU染色顯示�����,這種遷移在前腸5~7天�����,中腸7~10天����。與哺乳動物一樣,上皮翻轉(zhuǎn)和分化依賴于微生物定植��。有趣的是��,在斑馬魚中控制上皮細胞向分泌譜系分化的機制似乎是高度保守的,在哺乳動物中類似于Delta Notch信號���。在沒有缺口激活的情況下,所有上皮細胞分化為分泌譜系的細胞����。同樣,斑馬魚T細胞因子4(TCF4)在維持整個腸道的增殖性自我更新中是重要的�。鑒于這種高功能同源性,斑馬魚是研究腸上皮更新機制的一個很好的模型��。斑馬魚雖然沒有像哺乳動物那樣的5個腸段(即空腸��、十二指腸���、回腸����、盲腸(闌尾)和結(jié)腸)����,但它們具有功能同源性。在斑馬魚中�,三個不同的腸段在形態(tài)學和基因表達的基礎(chǔ)上被區(qū)分:前腸段(腸泡)�、中腸和后腸段����。消化酶強烈表達于最長的皺褶的前段。這些消化酶和溶質(zhì)轉(zhuǎn)運蛋白存在在腸的前部和中部突出了這兩個片段中營養(yǎng)吸收的功能�����。腸脂肪酸結(jié)合蛋白2在前腸和腸中部的表達最高����,IFABP6主要表達于后腸。中腸的最后部分含有上述空泡狀(M型)細胞�,這可能表明除了營養(yǎng)吸收外,該區(qū)域可能在粘膜免疫中起作用�。后部的上皮皺襞較短,這部分不含吸收的腸細胞�,但很可能與水吸收有關(guān)。對成年斑馬魚的腸道進行微陣列分析����,將其分成7個等長的段(從前1段到后7段)。
腸道微生物定植:地球上所有的動物�����,無論是水生動物還是陸地動物,都與環(huán)境中的微生物共同進化�����。從微生物生態(tài)學的研究進展來看����,微生物不僅寄生在宿主體內(nèi)��,而且對宿主的生理和免疫也有很大的影響�。反之亦然,宿主能夠控制哪些物種能夠在腸道內(nèi)定居��,通過對某些進行免疫應答而耐受其他物種�。在益生菌動物中進行的研究表明微生物對宿主有巨大的影響。微生物可以影響食品加工�,使其他不消化的食物成分可供宿主使用。同樣���,微生物可以合成維生素并刺激上皮更新����。在這212個基因中���,59個反應在小鼠和斑馬魚之間是保守的�����。這些保守的基因主要參與上皮細胞增殖���、促進營養(yǎng)代謝和先天免疫應答�。這表明對微生物的反應部分是高度保守的�。微生物通過處理不可觸及的食物成分來提高食物的能量吸收。在斑馬魚中����,微生物的存在也會導致脂肪組織中脂肪的增加。微生物抑制血管生成素樣蛋白4(ANGPTL4/FIAF)的腸上皮表達��。ANGPTL4/FIAF是脂蛋白脂肪酶的循環(huán)抑制劑�,通過抑制抑制劑的定植導致脂肪的儲存。飲食誘導的微生物群組成的改變��,如小鼠和人類��,影響脂肪吸收和宿主能量平衡��。微生物也誘導斑馬魚腸道發(fā)育。貝茨和同事發(fā)現(xiàn)�,在沒有微生物群的情況下,斑馬魚腸上皮在分化過程中停止��。他們觀察到缺乏刷狀腸堿性磷酸酶活性�����,表面上不成熟的糖蛋白表達模式和杯狀細胞和腸內(nèi)分泌細胞的缺乏��。此外����,在沒有微生物的情況下���,斑馬魚腸不能在小腸中攝取蛋白質(zhì)大分子�。顯示腸內(nèi)容物的轉(zhuǎn)運時間減少(更快的腸蠕動)�。用細菌定植這些魚逆轉(zhuǎn)了效果。有趣的是��,無細菌斑馬魚暴露于細菌脂多糖(LPS)或熱滅活細菌可以重建堿性磷酸酶活性�����,但不影響對聚糖的表達,表明存在不同的宿主微生物反應途徑���。據(jù)報道����,斑馬魚腸道中的上皮細胞增殖通過駐留微生物群的存在和Wnt信號轉(zhuǎn)導的激活來刺激���。他們表明�,穩(wěn)態(tài)先天免疫反應�,但不是炎癥信號有助于上皮增生的影響,因為微生物對上皮細胞的周轉(zhuǎn)需要MYD88�,而不是TNF受體。這也與小鼠發(fā)現(xiàn)一樣�����,細菌刺激誘導斑馬魚細胞中NF-κB(免疫基因表達的關(guān)鍵調(diào)節(jié)因子)���。無菌性斑馬魚激活NF-κB的細菌定植及其在腸和腸外組織中的靶基因表達�。在腸道菌群建立過程中�����,誘導刷毛酶堿性磷酸酶的表達。除了其在消化中的作用����,表明缺乏堿性磷酸酶的斑馬魚對LPS毒性敏感,并且顯示腸中性粒細胞水平升高����。這些發(fā)現(xiàn)說明微生物在斑馬魚腸道中形成中性粒細胞的穩(wěn)態(tài)水平。對小鼠堿性磷酸酶活性的進一步研究表明�����,它也具有先前未知的免疫功能����。
適應性免疫:在早期����,斑馬魚完全依賴于它們固有的免疫系統(tǒng),這使得在沒有適應性免疫的情況下研究先天免疫過程�����。以前認為適應性免疫系統(tǒng)直到4周后才成熟��。因為胸腺和頭腎(初級免疫器官)在早期幼蟲階段仍然是基本的。斑馬魚胸腺僅從4 WPF開始獲得更復雜的形狀����,髓質(zhì)中的TCRα恒定區(qū)陽性細胞在2~3 WPF中可見。在2 WPF時檢測到頭腎RAG-1的表達�����。原位雜交法報告9日齡斑馬魚食管和腸中的部分TCR陽性細胞���??傊?���,對于達到B和T細胞室功能成熟的年齡的證據(jù)仍然是有限的。LAM和同事們發(fā)現(xiàn)��,在4 WPF之前���,不能觀察到T細胞非依賴性和T細胞依賴性的免疫應答(IgM)����。表明斑馬魚免疫系統(tǒng)中的IgM反應在形態(tài)和功能上成熟于4~6 WPF���。然而��,這些研究是在鑒定IGZ之前進行的�����。IGZ-2轉(zhuǎn)錄物已經(jīng)檢測到2 WPF��,這可能表明這種反應的快速發(fā)展��。根據(jù)這些數(shù)據(jù)�����,目前比較安全的說法是�����,在生命的前兩周���,斑馬魚僅僅依靠先天免疫機制來防御。
先天免疫:抗菌肽(AMPS)��,由腸上皮細胞產(chǎn)生���,在幼蟲斑馬魚腸道形成第一道防線�����。AMPS是一種有效的廣譜抗菌藥物���。AMPS是能殺死革蘭氏陰性和革蘭氏陽性細菌�����、包膜病毒����、真菌甚至轉(zhuǎn)化或癌細胞的有效的廣譜抗菌劑�。在斑馬魚中,與其他魚類一樣�����,一些基因被復制和多樣化���,這可能導致這些細胞因子亞型的不同功能���。有趣的是�����,與小鼠相反�����,斑馬魚具有CXCL8(IL-8)��,其與人CXCL8的功能相似�。CXCL8是一種能吸引中性粒細胞的有效趨化因子���。斑馬魚CXCL8在白細胞和腸上皮細胞中表達��。已經(jīng)證明�,CXCL8L1(CXCL8A)在腸中的表達隨時間動態(tài)變化�。檢測到在1 WPF和成人年齡(14 WPF)的低表達水平,但在5 WPF中在分散的粒細胞和上皮細胞中的表達增加�。在5 WPF的RAG1缺陷斑馬魚中,CXCL8A的表達增加�����,而原位雜交只顯示一些分散的細胞的染色����,而它們的上皮細胞是陰性的。原始巨噬細胞也出現(xiàn)在血液循環(huán)開始之前����。這些原始巨噬細胞遷移到大腦形成小膠質(zhì)細胞,但能夠吞噬并殺死被注射的細菌�����。標記巨噬細胞的MPEG1轉(zhuǎn)基因斑馬魚特異性地顯示巨噬細胞存在��,盡管在整個胚胎包括小腸的28 HPF中的數(shù)量較低�,并且隨時間增加。最近���,通過使用巨噬細胞表達腫瘤壞死因子α(TNFA)的轉(zhuǎn)基因株系���,Nguyen Chi和同事報告了巨噬細胞亞群的存在。
腸道炎癥:為了充分利用斑馬魚的優(yōu)勢����,有幾個群體使用斑馬魚幼蟲和成蟲開發(fā)了腸道炎癥模型。隨著不同的先天免疫細胞的轉(zhuǎn)基因報告魚的發(fā)展�����,首次在健康和腸道炎癥期間可以監(jiān)測細胞募集。甚至在大多數(shù)轉(zhuǎn)基因斑馬魚可用之前���,F(xiàn)leming和他的同事就用實驗小鼠模型中的半抗原2���,4,6-三硝基苯磺酸(TNBS)開創(chuàng)了斑馬魚腸道炎癥的領(lǐng)域�。從3到8 dPF,將魚浸泡在75μg/mL的TNBS中�����,觀察到擴張的腸腔����,腸皺襞(絨毛)消失,杯狀細胞數(shù)量增加和5 DPF的上皮細胞出現(xiàn)上皮壞死因子α(TNF-α)陽性染色��。強的松和5-氨基水楊酸是IBD患者的兩種藥物�,改善了斑馬魚幼蟲中TNBS誘導的疾病。這證實了與人類疾病狀態(tài)相關(guān)的腸道生理學和病理學可以在斑馬魚幼蟲中進行建模�。浸泡在TNBS溶液中(50μg/ml 3天)的幼蟲表現(xiàn)出明顯的促炎標記物MMP9和白細胞增多。由于幼蟲浸泡不僅會對腸道造成損害,而且會對皮膚造成損害��,因此他們優(yōu)化了方案�,僅誘導腸道損傷而無皮膚損傷��。幼蟲暴露于75μg/ml TNBS三天����,表現(xiàn)出廣泛的皮膚損傷。暴露于低劑量TNBS或75μg/ml劑量的幼蟲在三天內(nèi)未出現(xiàn)皮膚損傷��。在TNBS暴露的幼蟲中觀察到增殖細胞數(shù)量的顯著增加�����。����,與小鼠和人類一樣,小腸結(jié)腸炎依賴于微生物群和Toll樣受體信號���,因為敲除MyD88導致TNBS暴露的死亡率增加�����。在后續(xù)研究中����,奧赫勒和他的同事們用DSS開發(fā)了另一種小腸結(jié)腸炎模型,并將小腸結(jié)腸炎與TNBS誘導的小腸結(jié)腸炎進行了比較����。DSS模型,如TNBS模型顯示嗜中性粒細胞炎癥���,依賴于微生物����。然而�,DSS模型也顯示出與TNBS誘導模型的顯著差異:DSS誘導的結(jié)腸炎顯示細菌過度生長,因為從整個幼蟲勻漿中的細菌計數(shù)比未處理或TNBS處理的幼蟲在暴露3天之后顯示出更高的計數(shù)��。暴露于TNBS后3天暴露的一氧化氮(NO)的增加在幼蟲暴露于DSS時是不可見的���。
結(jié)論:斑馬魚模型不僅可以用于研究人類疾病的潛在途徑��,它還可以作為研究水產(chǎn)養(yǎng)殖魚類如大西洋鮭魚食物誘發(fā)腸道炎癥的一個重要模型����。




 17312606166
17312606166