簡介:噻氯匹定通過ADP(二磷酸腺苷)���、血小板釋放反應和解聚作用抑制血小板聚集。臨床上常用于預防心��、腦血管等血栓栓塞性疾病�����。 然而�����,也有報道稱噻氯匹定對心臟有致畸作用,但其具體分子機制仍不清楚����。本研究以斑馬魚胚胎為模型生物,研究噻氯匹定的毒性效應����。暴露于6���、7.5和9 mg/L噻氯匹定溶液中的斑馬魚胚胎表現(xiàn)出幾種異常�,包括身體彎曲、眼睛變小����、卵黃囊吸收變慢、心包水腫���、心率變慢���、死亡率增加����、靜脈竇-動脈球(SV-BA)距離變長以及氧化應激增加,這表明發(fā)育和心臟毒性。觀察到與心臟發(fā)育相關(guān)的關(guān)鍵基因表達異常����,凋亡基因表達水平上調(diào)。 進一步的實驗揭示了噻氯匹定暴露后,胚胎氧化應激水平上調(diào)����,導致心肌細胞增殖減少。相反�����,芳香烴受體 (AHR) 抑制劑 CH223191 保護胚胎免受噻氯匹定的心臟毒性作用���,進一步證實了上調(diào)氧化應激作為噻氯匹定誘導斑馬魚心臟毒性分子機制的作用??傊?��,噻氯匹定暴露會導致斑馬魚胚胎的發(fā)育和心臟毒性。 因此���,需要進一步研究以確定噻氯匹定對人體的潛在危害,這對于指導臨床實踐安全用藥至關(guān)重要��。
關(guān)鍵詞:噻氯匹定 心臟毒性 氧化應激 心臟衰竭 芳香烴受體抑制劑
簡介:鑒于全球人口老齡化以及超重和肥胖的負擔日益加重����,糖尿病的患病率持續(xù)上升��,導致糖尿病相關(guān)大血管并發(fā)癥(包括冠心病���、腦梗死��、動脈硬化閉塞癥和血栓)的發(fā)病率和死亡率居高不下。眾所周知�����,高血糖導致氧化應激和炎癥增加�,而慢性炎癥����、內(nèi)皮功能障礙和高凝狀態(tài)之間的相互作用促進了糖尿病患者血管并發(fā)癥的發(fā)展�����。因此��,嚴格控制血糖水平并早期預防和治療糖尿病相關(guān)的大血管并發(fā)癥對于改善疾病的預后是不可或缺的�。噻氯匹定是噻吩吡啶的衍生物���,可通過多種誘導劑抑制血小板聚集����,如二磷酸腺苷(ADP)(包括外源性和內(nèi)源性ADP)、膠原��、凝血酶�、花生四烯酸和前列腺素中的過氧化物。常用于冠心病�����、腦梗死、血栓��、閉塞性動脈硬化�、動脈閉塞癥等患者。然而�����,最近的研究報道噻氯匹定具有免疫毒性和細胞毒性�����,在粒細胞中比在淋巴細胞中更明顯����。此外�,噻氯匹定可能導致秀麗隱桿線蟲咽部發(fā)育異常和身體變形���。其他研究也證明了噻氯匹定對非洲爪蟾的肝臟和心臟的發(fā)育毒性和致畸作用�,但具體的分子機制仍不清楚��。近年來��,斑馬魚是研究人類心血管疾病的優(yōu)秀模型。鑒于CRISPR/Cas9基因組編輯技術(shù)正在迅速發(fā)展,斑馬魚作為基因編輯模式生物的報告正在增加���。斑馬魚基因組全測序,現(xiàn)已公開,成為繼人類和小鼠之后的第三個高質(zhì)量基因組�����。斑馬魚和人類在基因和器官上有高度的同源性����。斑馬魚胚胎具有光學透明�����、體積小、生長快、產(chǎn)卵期短等優(yōu)點����,已廣泛應用于藥物篩選����。它也被廣泛用于檢測環(huán)境毒性和藥物毒性。斑馬魚和人類心臟生理學有很大的相似之處��,包括基本的收縮動力學和動作電位形態(tài)�����。此外,小胚胎通過被動擴散獲得足夠的氧氣,持續(xù)發(fā)育數(shù)天����,這并不完全取決于心血管系統(tǒng)的功能。 斑馬魚胚胎的這一特殊特征允許進一步研究患有嚴重心血管缺陷的動物。此外��,斑馬魚心臟由一個心房和一個心室組成��,在許多調(diào)節(jié)心臟形成的遺傳程序中與人類心臟一樣保守。斑馬魚心臟是第一個形成的器官���,在胚胎發(fā)育中起主要作用,早期心臟發(fā)育標志基因包括 myh6 ���、 vmhc ��、 gata4 �����、 nkx2.5 、 tbx5 和 tbx2b�。氧化應激與多種疾病的發(fā)生和衰老密切相關(guān)����。ROS是氧化應激的代謝產(chǎn)物,在胚胎發(fā)育中起重要作用����。過量的ROS可能會導致細胞內(nèi)線粒體活性失衡����,導致脂質(zhì)����、蛋白質(zhì)和核酸氧化�����,破壞其生物學功能。研究表明,芳香烴受體 (AHR) 介導有機物誘導的氧化應激�����,導致 DNA 損傷和細胞凋亡,從而導致心臟發(fā)育毒性��。 相反��,AHR 抑制劑 CH223191 可以顯著減少斑馬魚胚胎藥物引起的心臟畸形。本研究以斑馬魚為模型生物���,研究噻氯匹定的發(fā)育毒性和心臟毒性效應�,包括心率、死亡率���、心臟結(jié)構(gòu)變化����、氧化應激��、心臟發(fā)育關(guān)鍵基因和凋亡相關(guān)標記物的變化。我們的研究揭示了噻氯匹定對斑馬魚早期心臟和胚胎發(fā)育的毒性,為臨床用藥提供了有價值的指導��。
噻氯匹定引起的發(fā)育毒性:與對照組相比���,在用不同濃度(6���、7.5、9 mg/L)的噻氯匹定處理的72 hpf 時斑馬魚胚胎中觀察到心包水腫�����,在整體和個體斑馬魚胚胎中均發(fā)現(xiàn)具濃度依賴性的。噻氯匹定處理的胚胎有明顯的尾部彎曲和卵黃囊吸收���。噻氯匹定溶液治療后眼較對照組小���。與對照組相比,噻氯匹定溶液處理組的卵黃面積較大,因為卵黃吸收較慢��。
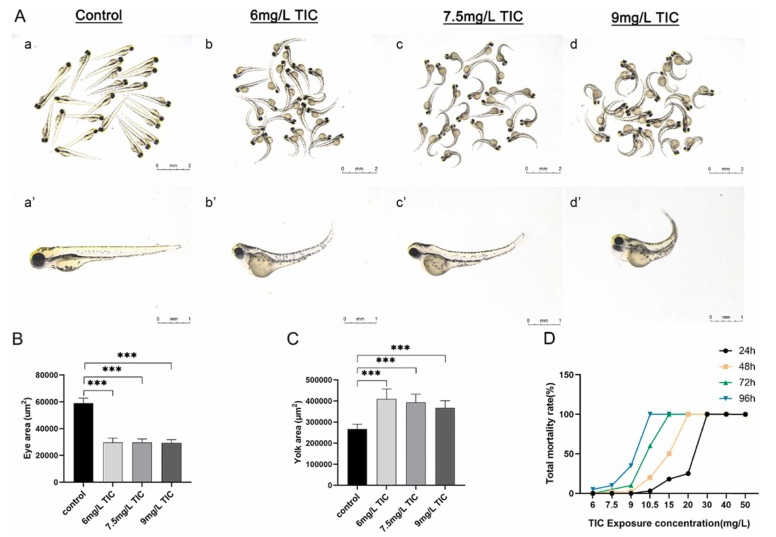
圖 1��、 暴露于不同濃度噻氯匹定的斑馬魚胚胎表型特征����。噻氯匹定處理胚胎的死亡率也以濃度依賴性方式增加�����, 用 20mg/L 噻氯匹定處理48�����、72 和 96 hpf的胚胎觀察到 100% 的死亡率���。在24��、48、72和96hpf時,噻氯匹定的LC50為22.68?mg/l��,14.71??mg/l��,10.30?mg/L和9.214?mg/L��。
噻氯匹定引起的心臟毒性: 暴露于噻氯匹定后,心房和心室之間的間距逐漸拉長��,在熒光顯微鏡下呈線性化趨勢���。隨著噻氯匹定溶液濃度的增加�����,心率逐漸降低��,觀察到靜脈竇與動脈球之間的距離明顯長于對照組�。如激光共聚焦顯微鏡所示隨著噻氯匹定濃度的增加房室瓣之間的距離變寬����,而綠色熒光顯示心臟較弱且有缺陷,表明心肌細胞受損���。
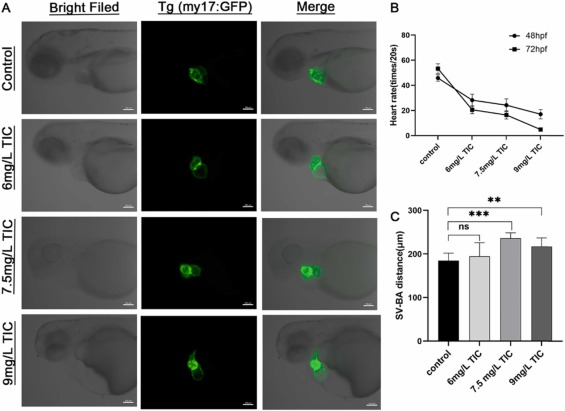
圖2、暴露于噻氯匹定的斑馬魚胚胎的心臟表型特征�����。
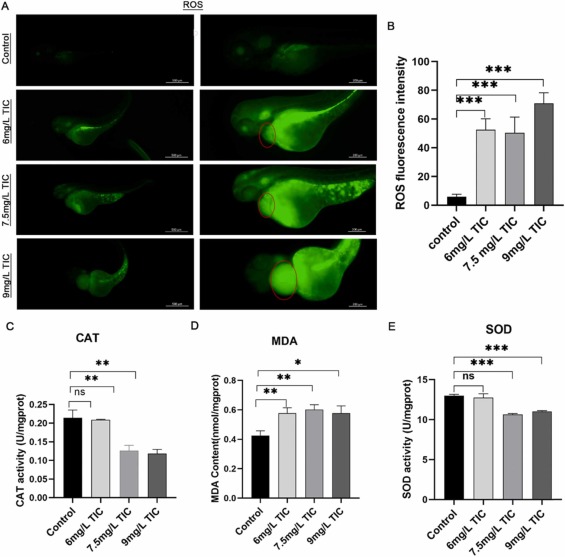
圖3�、噻氯匹定暴露引起的氧化應激。
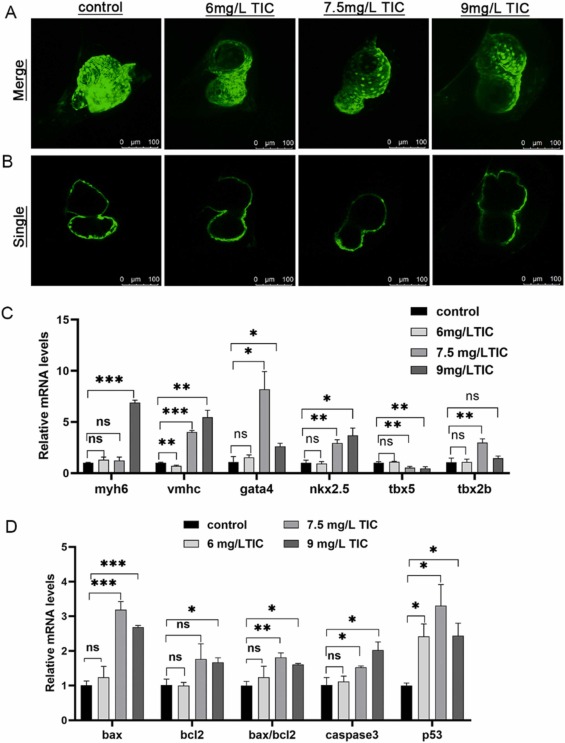
圖 4. 噻氯匹定暴露后心臟和基因表達水平的共焦代表性圖像�。
噻氯匹定引起氧化應激增加:綠色熒光位點代表活性氧的積累位點���。與對照組相比�,治療組的綠色熒光強度明顯更高�����,而綠色熒光面積也更大����,集中在頭部���、心臟�����、肝臟、卵黃和腸道���。同時���,與氧化應激相關(guān)的酶活性增強���。噻氯匹定降低了CAT和SOD的活性�,表明胚胎的抗氧化能力降低。MDA含量上調(diào)����,表明氧化應激導致細胞膜損傷�。這些發(fā)現(xiàn)表明�,氧化應激相關(guān)損傷是噻氯匹定處理的胚胎心臟毒性機制之一��。
噻氯匹定誘導斑馬魚胚胎細胞心臟基因異常表達和凋亡�����,抑制心肌細胞增殖:與對照組相比�,噻氯匹定處理的斑馬魚胚胎中 myh6���、vmhc、gata4����、nkx2.5、tbx5 和 tbx2b 的表達水平失調(diào)�,這與心臟發(fā)育有關(guān)����。凋亡相關(guān)基因bax、caspase 3���、p53和bax/bcl2的水平顯著上調(diào)�,且與噻氯匹定濃度呈劑量依賴關(guān)系�。AO染色結(jié)果顯示��,與對照組相比����,TIC處理組斑馬魚胚胎的頭部���、眼睛和心包有明顯的凋亡�。TUNEL染色顯示對照組和TIC治療組心肌細胞凋亡不明顯。陽性對照組細胞凋亡明顯��。PCNA增殖染色結(jié)果顯示,對照組心肌細胞增殖����,TIC組心肌細胞未見明顯增殖。這些結(jié)果表明����,噻氯匹定可誘導斑馬魚胚胎細胞凋亡���,心臟毒性可能與細胞凋亡無關(guān)���,但主要影響心肌細胞的增殖�����。
CH223191減輕噻氯匹定引起的心臟毒性:與7.5 mg/L噻氯匹定治療組相比����,7.5 mg/L噻氯匹定 + 0.25 μM CH223191恢復組部分表現(xiàn)出正常的心臟形態(tài)和心率。此外���,動脈竇球間距的延長也較少���。共聚焦顯微鏡檢查發(fā)現(xiàn)���,7.5 mg/L噻氯匹定 + 0.25 μM CH223191恢復組與7.5 mg/L噻氯匹定治療組相比,房室瓣間距變窄,綠色熒光增強��,心臟位置正常����。這些發(fā)現(xiàn)表明 CH223191 適度地對抗噻氯匹定誘導的心臟毒性作用����。
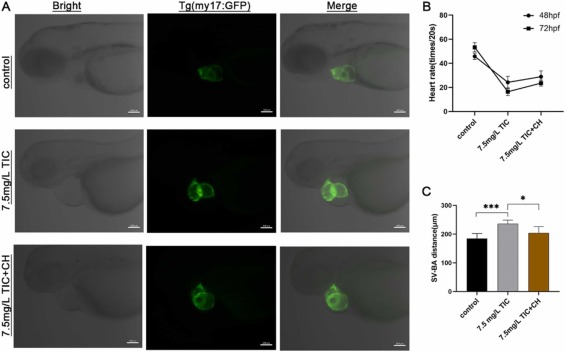
圖5、CH223191逆轉(zhuǎn)噻氯匹定引起的心臟毒性。
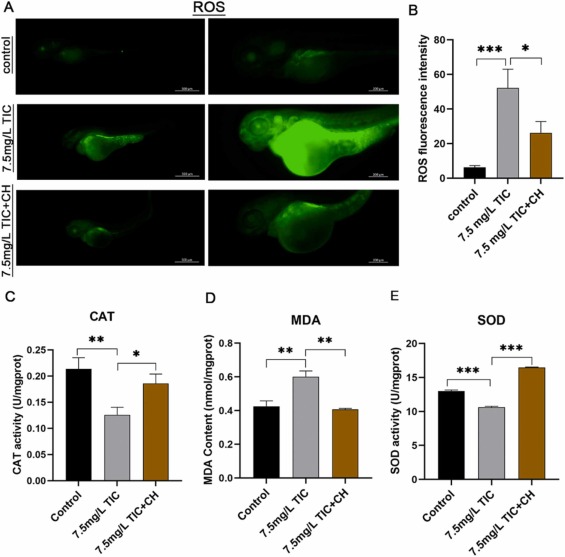
圖 6. CH223191 減輕噻氯匹定暴露引起的氧化應激。
CH223191下調(diào)噻氯匹定誘導的氧化應激:為了進一步證實在斑馬魚胚胎中觀察到的心臟毒性可能是由噻氯匹定誘導的氧化應激引起的���,在72 hpf收集對照組、7.5 mg/L噻氯匹定治療組�����、7.5 mg/L噻氯匹定 + 0.25 μM CH223191恢復組的斑馬魚胚胎���。 . 用 AHR 抑制劑 CH223191 拯救了斑馬魚胚胎�。 胚胎被 ROS 染色。與7.5 mg/L噻氯匹定組相比,噻氯匹定 + 0.25 μM CH223191組心臟及其他部位ROS表達顯著降低��,且與對照組相比,CH223191組CAT��、SOD活性和MDA含量恢復。進一步表明���,噻氯匹定誘導的心臟毒性作用與氧化應激機制密切相關(guān),CH223191可對抗氧化應激機制����。與7.5 mg/L噻氯匹定相比��,7.5 mg/L噻氯匹定+ 0.25 μM CH223191挽救組心臟發(fā)育相關(guān)基因myh6、vmhc��、gata4���、nkx2.5�����、tbx5和tbx2b的表達水平有所恢復。此外,挽救組凋亡相關(guān)基因bax��、caspase3��、p53的水平以及bax/bcl2的比值也有所恢復��。AO染色顯示7.5 mg/L噻氯匹定組頭部���、眼部和心包細胞凋亡�����,而7.5 mg/L + 0.25 μM CH223191組細胞凋亡減少。PCNA增殖染色顯示7.5 mg/L + 0.25 μM CH223191挽救組心肌細胞增殖明顯高于7.5 mg/L噻氯匹定組����。 這些結(jié)果表明 CH223191 通過促進心肌細胞增殖來挽救噻氯匹定誘導的心臟毒性�����。
討論:氧化應激是指活性氧的產(chǎn)生和抗氧化作用之間的不平衡�。 在環(huán)境���、疾病等有害因素的刺激下��,由于ROS過度積累、中性粒細胞炎癥浸潤、蛋白酶分泌增加���、大量氧化中間體的產(chǎn)生�����,導致?lián)p傷�。研究表明��,活性氧升高影響心肌細胞分化中關(guān)鍵基因的表達����,導致斑馬魚胚胎心臟發(fā)育缺陷�����。此外����,氧化應激與疾病和衰老密切相關(guān)�����。生物體內(nèi)有兩種主要的抗氧化系統(tǒng),即非酶系統(tǒng)和酶系統(tǒng)。 非酶系統(tǒng)直接淬滅 ROS�,而酶系統(tǒng)由解毒 ROS 的特定酶組成���。觀察到 CAT、MDA 和 SOD 的酶活性在調(diào)節(jié)氧化應激中起著至關(guān)重要的作用���。MDA作為氧自由基在氧化變性過程中的產(chǎn)物��,被認為是脂質(zhì)過氧化的指標。SOD是一種抗氧化金屬酶��,通過催化超氧陰離子自由基歧化生成氧氣和過氧化氫���,在平衡氧化和抗氧化方面發(fā)揮重要作用���。另一方面��,CAT催化過氧化氫分解成氧氣和水����,是過氧化物酶體的標志酶�����。在食品工業(yè)中�����,CAT用于食品包裝,以防止食品氧化�。我們的研究結(jié)果顯示�,與對照組相比,噻氯匹定治療組的綠色熒光分布明顯更亮��、更大��,表明噻氯匹定治療后可誘導ROS的積累�。此外��,與對照組相比,噻氯匹定治療組的CAT和SOD活性顯著下調(diào)���,而MDA含量上調(diào)�,表明噻氯匹定暴露可導致氧化應激失衡,ROS的過度積累導致CAT和SOD活性降低�����,MDA含量升高�����,導致斑馬魚胚胎心臟毒性���。為了探索噻氯匹定引起心臟毒性的分子機制�����,我們檢測了心臟發(fā)育早期的幾個關(guān)鍵基因。myh6����、vmhc�、gata4����、nkx2.5�、tbx5 和 tbx2b 等轉(zhuǎn)錄因子在心臟發(fā)育中是不可或缺的��。 Myh6 在心臟中高度表達,編碼心臟 α-肌球蛋白重鏈。 研究表明myh6突變與心肌病和房間隔缺損有關(guān)����。gata4 的異常表達已被證明會導致心臟畸形和先天性心臟病 (CHD)。Vmhc也是心臟的標記基因����,Vmhc的表達先于myh6,tbx5和gata4的表達紊亂可能導致心臟間隔瓣缺損���。Nkx2.5 是心肌細胞分化的關(guān)鍵,并維持特定的心室表型�����。斑馬魚心肌中tbx2b的異常水平可能導致發(fā)育性心臟缺陷���。我們的研究結(jié)果表明,接觸噻氯匹定溶液會導致心臟發(fā)育關(guān)鍵基因水平的失調(diào)����。Tbx5基因被明顯抑制,但其他與心臟發(fā)育相關(guān)的基因被激活�。這些基因的異常表達可能導致心臟間隔瓣缺損和心臟畸形���。 因此�����,我們推測噻氯匹定引起的發(fā)育異常和心臟毒性可能是由于ROS過度積累導致心臟基因表達失調(diào)引起的����。我們還研究了噻氯匹定對斑馬魚胚胎心臟細胞增殖和凋亡的影響。 眾所周知��,ROS的積累會影響p53的穩(wěn)定表達�。P53通過抑制抗凋亡基因bcl2和誘導促凋亡基因Bax調(diào)控細胞周期和凋亡。QPCR結(jié)果顯示�����,噻氯匹定溶液暴露組細胞凋亡誘導基因顯著上調(diào)�����,提示噻氯匹定可誘導細胞凋亡��。AO染色和TUNEL染色提示�����,與對照組相比,噻氯匹定溶液暴露組未引起心肌細胞凋亡增加���,而是誘導頭部、眼部�、心包等部位細胞凋亡。結(jié)果表明,噻氯匹定引起的心臟毒性可能是由于ROS過度積累導致心臟基因表達失調(diào)和心肌細胞增殖減少所致����。
結(jié)論:噻氯匹定誘導的斑馬魚胚胎心臟發(fā)育毒性歸因于AHR介導的氧化應激。氧化應激導致活性氧的積累,抑制心肌細胞增殖,并干擾心臟發(fā)育相關(guān)基因的表達��。需要進一步研究以確定噻氯匹定對人體的潛在危害����,這為臨床安全用藥提供了必要的證據(jù)。
原文出自:Ticlopidine induces cardiotoxicity in zebrafish embryos through AHR-mediated oxidative stress signaling pathway - ScienceDirect




 17312606166
17312606166